衛材在華企業隸屬于衛材株式會社,衛材株式會社是一家以研究開發醫藥產品為主的跨國公司,總部設在日本東京,中國區總部位于上海。
衛材自上世紀90年代初進入中國市場以來順利發展壯大,在華總注冊資本10,854萬美金,成員企業包括衛材(中國)投資有限公司、衛材(中國)藥業有限公司、衛材(遼寧)制藥有限公司、衛材(蘇州)貿易有限公司、衛材香港有限公司,并合資建立京頤衛享(上海)健康產業發展有限公司,其旗下“銀發通”獲得上海市靜安區衛健委頒發的互聯網醫院牌照。目前,企業形成以神經科學、腫瘤(特藥)、消化肝病為重點領域,拓展仿制藥等其它領域,線上線下銷售多達數十種藥品和其它產品,在華日資企業排名第二,在華外資制藥企業排名第17位。
2018年位于蘇州工業園區興浦路的新工廠正式運營,廠房面積2.3萬平米,設計產能年制劑30億片及包裝50億片,產能得到迅速提升。作為集團主力工廠之一,未來蘇州工廠生產的產品除了滿足中國市場需求,還將作為全球供應鏈中的一部分提供全球保障。
衛材所有在華企業秉承hhc(human health care,關心人類健康)企業宗旨,以Compliance(遵守道德)為行為準則,以GMP為質量標準,向患者及其家屬提供高質、環保、安全和滿意的產品和服務。
]]>III期臨床研究CLEAR試驗(研究307)/KEYNOTE-581的結果將在即將召開的醫學會議上發布
日本東京與美國新澤西州肯尼沃斯,2020年11月10日——衛材株式會社(總部:日本東京,CEO:內藤 晴夫,下文簡稱“衛材”)和默克集團(美國新澤西州肯尼沃斯,在美國和加拿大境外稱為MSD)近日宣布了新的研究數據,證明關鍵性III期CLEAR試驗(研究307)/KEYNOTE-581獲得了陽性結果。該試驗旨在評價衛材研發的口服多靶點酪氨酸激酶受體抑制劑LENVIMA?與MSD的抗PD-1治療藥物KEYTRUDA?聯合治療或與依維莫司聯合治療對比舒尼替尼用于晚期腎細胞癌(RCC)患者一線治療的療效。
LENVIMA + KEYTRUDA聯合治療達到了試驗的主要終點(PFS)以及關鍵次要終點(OS和ORR),研究數據證實在意向治療(ITT)研究人群中,與舒尼替尼相比,聯合治療方案使患者PFS、OS和ORR表現出具有統計學意義和臨床意義的顯著改善。LENVIMA +?依維莫司聯合治療也達到了主要終點(PFS)和關鍵次要終點(ORR),證明在ITT研究人群中,與舒尼替尼相比,使患者PFS和ORR表現出具有統計學意義和臨床意義的顯著改善。ITT人群包括斯隆-凱特琳癌癥中心(Memorial Sloan Kettering Cancer Center, MSKCC)所有風險組的患者(低危、中危、高危)。LENVIMA + KEYTRUDA和LENVIMA +?依維莫司聯合治療的安全性特征與既往研究報告的一致。衛材和默克(美國新澤西州肯尼沃斯)將與全球監管機構對這些數據進行討論,以便根據這些結果提交上市許可申請。這些數據將在即將召開的醫學會議上介紹。
“越來越多的科學證據支持將基于KEYTRUDA的聯合用藥方案作為晚期腎細胞癌患者的一線治療進行研究,鑒于此,我們對KEYTRUDA + LENVIMA聯合方案與舒尼替尼單藥方案進行了比較,結果顯示,KEYTRUDA + LENVIMA聯合治療使患者的PFS、OS和ORR表現出有統計學意義的顯著改善”,默克研究實驗室腫瘤學臨床研究副總裁Gregory Lubiniecki博士說,“默克將攜手衛材,繼續探索KEYTRUDA + LENVIMA聯合用藥的潛力,特別是在腎細胞癌等需求尚未得到充分滿足的領域。”
?“CLEAR(研究307)/KEYNOTE-581的結果表明KEYTRUDA + LENVIMA具有作為晚期RCC一線治療的潛力。這些數據也證明LENVIMA +?依維莫司(該聯合方案已被FDA批準用于既往接受過抗血管生成治療的晚期RCC患者)具有用作一線治療的潛力,”?衛材副總裁兼腫瘤業務組首席醫學創新官和首席發現官Takashi Owa博士說,“這些發現激勵著我們不斷深入了解并解決難治癌癥患者未滿足的需求”。
衛材和默克(美國新澤西州肯尼沃斯)正在通過LEAP(侖伐替尼和帕博利珠單抗,LEnvatinib?And?Pembrolizumab)臨床項目繼續研究LENVIMA + KEYTRUDA聯合用藥的情況,涉及19項試驗、13種不同腫瘤類型,這些腫瘤類型包括子宮內膜癌、肝細胞癌、黑色素瘤、非小細胞肺癌、RCC、頭頸部鱗狀細胞癌、尿路上皮癌、膽道癌、結直腸癌、胃癌、膠質母細胞瘤、卵巢癌和三陰性乳腺癌。
關于CLEAR(研究307)/KEYNOTE-581
CLEAR(研究307)/KEYNOTE-581是一項評價LENVIMA聯合KEYTRUDA或依維莫司與舒尼替尼單藥相比,用于晚期RCC患者一線治療的多中心、隨機、開放性、III期試驗(ClinicalTrials.gov,NCT02811861)。本研究共入組約1050例患者,隨機分為三個治療組,分別接受LENVIMA(18 mg,口服,每日一次)聯合依維莫司(5 mg,口服,每日一次)[A組];或LENVIMA(20 mg,口服,每日一次)聯合KEYTRUDA(200 mg,靜脈給藥,每3周一次)[B組];或舒尼替尼(50 mg,口服,每日一次,治療4周,隨后停藥2周)[C組]。主要終點是根據RECIST v1.1標準,通過獨立審查評估比較A組與C組以及B組與C組之間的PFS。關鍵次要終點為OS、ORR和安全性。
?
關于腎細胞癌(RCC)
據估計,2018年全球新診斷腎癌病例超過403,000例,死亡病例超過175,000例1。2018年,日本新發病例超過24,000例,死亡8000例1。據估計,僅在美國,2020年將有近74, 000例新發腎癌確診病例,死亡病例近15,000例2。腎細胞癌是目前最常見的腎癌類型,10例腎癌中就約有9例為腎細胞癌3。男性中腎細胞癌更常見,發生率約為女性的兩倍4。大多數RCC病例是在其他腹部疾病的影像學檢查中偶然發現的。約30%的RCC患者在診斷時即已轉移,多達40%的患者在因局限性RCC接受初次手術治療后發生轉移5,6。患者的生存率高度依賴于診斷時的腫瘤分期,存在轉移的患者的五年生存率為12%,預后較差7。
?
關于LENVIMA?(侖伐替尼)膠囊
LENVIMA是由衛材發現并開發的一種多靶點酪氨酸激酶受體抑制劑,可抑制血管內皮生長因子(VEGF)受體VEGFR1(FLT1)、VEGFR2(KDR)和VEGFR3(FLT4)的激酶活性。除正常細胞功能外,LENVIMA還可抑制與致病性血管生成、腫瘤生長和癌癥進展相關的其他激酶,包括成纖維細胞生長因子(FGF)受體FGFR1-4、血小板衍生生長因子受體α(PDGFRα)、KIT和RET。在同系小鼠腫瘤模型中,與任一藥物單獨給藥相比,侖伐替尼聯合抗PD-1單克隆抗體可減少腫瘤相關巨噬細胞的數量,增加活化的細胞毒性T細胞的數量,表現出更強的抗腫瘤活性。LENVIMA和依維莫司聯合用藥顯示抗血管生成和抗腫瘤活性增加,在體外試驗中表現為人內皮細胞增殖、血管形成和VEGF信號轉導減弱,在人腎細胞癌小鼠移植瘤模型中腫瘤體積的縮小程度大于每種藥物單獨給藥時的縮小程度。目前,LENVIMA已在超過65個國家(包括日本、美國、歐洲和亞洲的部分國家)獲批單藥用于甲狀腺癌的治療,并在超過65個國家(包括日本、美國、歐洲部分國家、中國和亞洲部分其他國家)獲批單藥用于不可切除肝細胞癌的治療。此外,在超過55個國家(包括美國、歐洲和亞洲的部分國家),LENVIMA還被批準與依維莫司聯合用藥,治療既往曾接受過抗血管生成治療的腎細胞癌患者。在歐洲,LENVIMA以商品名Kisplyx?上市,用于治療腎細胞癌。同時,LENVIMA也在美國、澳大利亞和加拿大等國家獲批與KEYTRUDA聯合,治療既往接受全身治療后出現疾病進展的,不適合根治性手術或放療的,非微衛星高度不穩定(MSI-H)或錯配修復缺陷(dMMR)的晚期子宮內膜癌患者。該適應癥的持續批準取決于各項確證性試驗中臨床獲益的驗證和描述。
?
關于KEYTRUDA?(帕博利珠單抗)注射液
KEYTRUDA是一種抗PD-1治療藥物,通過提高人體免疫系統檢測和抗擊腫瘤細胞的能力發揮作用。KEYTRUDA是一種人源化單克隆抗體,可阻斷PD-1與其配體PD-L1和PD-L2之間的相互作用,從而激活T淋巴細胞,這種淋巴細胞可能對腫瘤細胞和健康細胞均有作用。
默克(美國新澤西州肯尼沃斯)目前正在進行行業內規模最大的免疫腫瘤學臨床研究項目。目前有1200多項在多種癌癥和治療環境中研究KEYTRUDA的試驗。KEYTRUDA臨床項目旨在了解KEYTRUDA在癌癥中的作用,以及可以通過哪些因素來預測一名患者是否能從KEYTRUDA治療中獲益,包括探索幾種不同的生物標志物。
?
關于默克(美國新澤西州肯尼沃斯)和衛材的戰略合作
2018年3月,衛材和默克(美國新澤西州肯尼沃斯,在美國和加拿大境外稱為MSD)通過一家附屬公司,就LENVIMA的全球共同開發和共同商業化達成戰略合作。根據協議,兩家公司將聯合開發、生產LENVIMA并將其商業化。?LENVIMA既可作為單藥治療也可與默克(美國新澤西州肯尼沃斯)的抗PD-1治療藥物KEYTRUDA聯合用藥。
除了在幾種不同腫瘤類型中正在進行的評價KEYTRUDA與LENVIMA聯合用藥的臨床研究外,兩家公司還通過LEAP(侖伐替尼聯合帕博利珠單抗,LEnvatinib?AndPembrolizumab)臨床項目共同發起新的臨床研究來評價該聯合用藥,涉及19項臨床試驗、13種不同腫瘤類型(子宮內膜癌、肝細胞癌、黑色素瘤、非小細胞肺癌、腎細胞癌、頭頸部鱗狀細胞癌、尿路上皮癌、膽道癌、結直腸癌、胃癌、膠質母細胞瘤、卵巢癌和三陰性乳腺癌)。
?
衛材專注于癌癥
衛材專注于抗癌藥物的研發,致力于腫瘤微環境(從現有的自主研發的化合物中得到了大量的經驗和知識)以及驅動基因突變及異常剪接的因素(利用RNA剪切平臺)等領域(Ricchi)。在這些領域,還有很多患者的需求未得到真正的滿足,衛材希望成為腫瘤學領域的領導者。衛材希望從這些Ricchi?中發現具有新靶點、新作用機制并有望治愈癌癥的創新藥。
?
關于衛材
衛材是一家全球領先的研發型制藥公司,總部位于日本,在全球約有10, 000名員工。Eisai將企業使命定義為“將患者及其家屬的利益放在首位,為提升其福祉做出貢獻”,公司將這種使命稱為關心人類健康(hhc)理念。衛材致力于在腫瘤學和神經病學等醫療需求高度未得到滿足的治療領域提供創新產品,努力實現公司的hhc理念。本著hhc的精神,衛材會進一步履行這一承諾,運用公司擁有的科學專業知識、臨床能力和對患者的了解,發現并開發創新解決方案,幫助解決社會最棘手的未得到滿足的需求,包括被忽視的熱帶病和可持續發展目標。
有關衛材的更多信息,請訪問www.eisai.com(適用于全球)、us.eisai.com(適用于美國)或www.eisai.eu(適用于歐洲、中東、非洲),也可通過Twitter(美國和全球)和LinkedIn(僅適用于美國)與我們聯系。
?
默克(美國新澤西州肯尼沃斯)專注于癌癥
默克集團的目標是將突破性科學轉化為創新型腫瘤藥物,以造福全球癌癥患者。在默克(美國新澤西州肯尼沃斯),為癌癥患者帶來新希望的潛力推動了公司的目標,支持癌癥藥物的可及性是公司的承諾。作為關注癌癥的一部分,默克(美國新澤西州肯尼沃斯)致力于探索腫瘤免疫學的潛力,這是該行業中最大的開發項目之一,涵蓋30多種腫瘤類型。公司還將繼續通過戰略性收購來加強公司的產品組合,并優先開發具有潛力的幾種有望改善晚期癌癥治療的腫瘤候選藥物。有關公司腫瘤學臨床試驗的更多信息,請訪問www.merck.com/clinicaltrials。
?
關于默克(美國新澤西州肯尼沃斯)
在超過125年的時間里,默克(美國新澤西州肯尼沃斯,在美國和加拿大境外稱為MSD)一直致力于為生命的延續而發明藥物,為世界上很多最具挑戰性的疾病提供藥物和疫苗,以實現公司拯救生命和改善生活的使命。公司通過影響深遠的政策、項目和伙伴關系增加獲得醫療保健的機會,以示公司對患者和人群健康的承諾。如今,默克(美國新澤西州肯尼沃)在預防和治療威脅人類和動物的疾病(包括癌癥、HIV和埃博拉病毒等感染性疾病以及新出現的動物疾病)領域,一直保持走在前沿,致力于成為全球領先的研發密集型生物制藥公司。欲了解更多信息,請訪問www.merck.com,并通過Twitter、Facebook、Instagram、YouTube和LinkedIn與公司聯系。
?
默克(美國新澤西州肯尼沃斯)的前瞻性聲明
默克(美國新澤西州肯尼沃斯,下文簡稱“公司”)的新聞稿中包含“前瞻性聲明”,這些聲明是根據1995年美國私人證券訴訟改革法案中的安全港規定做出的。這些前瞻性聲明基于公司管理層目前的信念和期望,并受制于可能出現的重大風險和不確定因素。對于管線產品,無法保證產品將獲得必要的監管批準或證明其會取得商業化成功。如果基本假設被證明不準確或存在風險或不確定性,則實際結果可能會與前瞻性聲明所列結果存在重大差異。
風險和不確定性包括但不限于一般行業狀況和競爭;一般經濟因素,包括利率和貨幣匯率波動;全球爆發的新型冠狀病毒疾病(COVID-19)的影響;美國和國際制藥行業監管和醫療保健立法的影響;控制醫療保健成本的全球趨勢;技術進步,競爭者獲得的新產品和專利;新產品開發固有的挑戰,包括獲得監管批準;公司準確預測未來市場情況的能力;生產困難或延誤;國際經濟的金融不穩定性和主權風險;對公司專利和創新產品其他保護的有效性的依賴性;以及訴訟風險,包括專利訴訟和/或監管行動。
公司無義務公開更新任何前瞻性聲明,無論該等更新是基于新信息、未來事項,或者任何其他原因。可能導致結果與前瞻性聲明中所述結果有實質性差異的其他因素見公司向證券交易委員會(SEC)提交的公司2019年年度報告10-K表格和其他申報文件,可訪問SEC網站(www.sec.gov)查閱這些資料。
1?GLOBOCAN2018:2012-2018年全球癌癥發病率、死亡率和患病率估計值。https:///gco.iarc.Fr/today/data/factsheets/cancer/29-Kidney-fact-sheet.pdfhttp:///globocan.iarc.fr/.
2?美國國家癌癥研究所,監測、流行病學和最終結果項目(SEER)“癌癥統計資料:腎及腎盂癌”https://seer.cancer.gov/statfacts/html/kidrp.html.
3?美國癌癥協會,“有關腎癌的關鍵統計數據”?https://www.cancer.org/cancer/kidney-cancer/about/key-?statistics.html.
4?《有關腎癌的關鍵統計數據》美國癌癥協會。https://www.cancer.org/cancer/kidney-cancer/about/key-statistics.html.
5?Thomas A. Z. et al.?轉移瘤切除術在腎細胞癌伴肉瘤樣分化患者中的作用:匹配對照分析。美國泌尿外科雜志?2016年9月;第196(3)期: 第678-684頁https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5014677/.
6?Shinder B et al. 晚期和轉移性腎細胞癌的外科治療:多學科方法腫瘤學前言雜志2017年;第7期:第107頁.?https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5449498/# ffn sectitle.
7?Padala, S. A., Barsouk, A., Thandra, K. C., Saginala, K., Mohammed, A., Vakiti, A., Rawla, P., & Barsouk, A. (2020). 腎細胞癌流行病學。世界腫瘤學雜志,第11 (3)期,第79-87頁https://doi.org/10.14740/wjon1279.
]]>希森美康集團(總部:日本神戶;董事長兼CEO:家次恒;下文簡稱希森美康)和衛材株式會社(總部:日本東京;CEO:內藤晴夫;下文簡稱衛材)宣布,在2020年11月4日至7日召開的第13屆阿爾茨海默病臨床試驗(CTAD)會議上介紹了用血漿診斷阿爾茨海默病(AD)方法開發項目的最新數據。希森美康代表兩家公司展示了使用希森美康HISCLTM全自動免疫分析儀測量的血漿β-淀粉樣蛋白在預測淀粉樣病理方面的性能,其中淀粉樣病理的判定使用淀粉樣蛋白正電子發射斷層掃描(PET)成像Centiloid量表1。
預計全世界癡呆癥患者的總人數將在2030年達到8200萬,在2050年達到1.52億,全球癡呆癥的總社會成本來自于直接醫療成本、社會護理成本以及生產力的下降,估計到2030年社會總成本將達到2萬億美元6。在日本,癡呆患者的數量在2012年已達到約462萬,預計在2025年將增至730萬7,估計2025年該疾病的總社會成本將相當于國內生產總值(GDP)的4.1%8(25.8萬億日元9)。在這些癡呆患者中,AD患者占60%以上7。
已知AD是一種由神經元外Aβ蛋白聚集觸發神經元內tau蛋白沉積,從而導致突觸功能障礙和神經元細胞死亡的疾病。這些腦部改變可引起認知障礙和心理與行為癥狀,提示在認知障礙之前,AD就已引起腦內Aβ的聚集和積聚。因此,認為在以Aβ為靶點的治療中,早期診斷和早期干預更為有效。目前檢測腦內淀粉樣蛋白聚集的方法為淀粉樣蛋白PET成像和腦脊液(CSF)Aβ比值檢測,但這兩種方法在獲取途徑、費用和身體健康方面給患者帶來了沉重的負擔10。
希森美康和衛材正在努力創建新的用于預防和治療癡呆的診斷技術。因此,首要目標是促進醫療保健的進步,提高癡呆患者及其家屬的生活質量。
術語
1?一個標準化量表,用于對不同淀粉樣蛋白PET成像探針測量的PET SUVR值進行綜合分析。
2?經過培訓的醫生通過視覺讀片,可定性鑒別淀粉樣蛋白PET陽性受試者和淀粉樣蛋白陰性受試者。
3 Klunk WE?et al,?Alzheimer’s Dementia (2014)
4?基于兩個定量數據分布評估兩組數據的相關性。為了進行本分析,計算了Spearman秩相關系數(rs),rs是由兩個變量的秩次確定的一個相關指數。
5 Schindler SE?et al,?Neurology (2019)
6 2018年世界阿爾茨海默病報告
7?癡呆綜合措施的推廣,日本厚生勞動省
8?日本癡呆經濟影響研究,2014年衛生勞動科學研究補助年度報告
9?希森美康根據日本中期經濟展望(2018年2月)估算,日本大和研究所
10 Aβ是由淀粉樣前體蛋白切除的氨基酸殘基組成的肽。其中許多是由40個殘基組成的Aβ1-40,其水平不會隨著AD的進展而明顯波動。另一方面,由42個殘基組成的Aβ1-42具有高聚集性,腦脊液(CSF)中的Aβ1-42從AD早期就開始減少。認為Aβ的絕對值表現出個體和內在變異性,但血漿Aβ1-42/Aβ1-40比值保持不變。據報道,CSF中Aβ1-42/Aβ1-40比值與淀粉樣蛋白PET高度相關。
關于希森美康與衛材的合作
2016年2月,希森美康和衛材簽署了一項全面的非排他性協議,旨在為癡呆領域開發新的診斷檢測。兩家公司在技術和知識方面彼此借力,共同致力于研發新一代的診斷試劑,以便能夠早期診斷癡呆、選擇最合適的治療方案,并定期監測此類治療的效果。在2019年12月舉行的第12屆CTAD上,兩家公司報告了使用全自動免疫分析系統HISCL測量的血漿Aβ比值預測淀粉樣蛋白PET掃描結果的性能(敏感性:73%,特異性:71% [AUC=0.74]),結果證明了使用血漿Aβ比值預測腦淀粉樣病理的潛力*。這一發現有望開發一種用血液診斷阿爾茨海默病的簡單方法。
*https://www.sysmex.co.jp/en/news/2019/191209.html
https://www.eisai.com/news/2019/news201990.html
咨詢聯系
IR和企業宣傳部????????????????????????? 公共關系部
希森美康集團????????????????????????? ? ? 衛材株式會社
電話:078-265-0500???????????? ? 電話:03-3817-5120
截至公告之日,本新聞稿中包含的信息為最新信息,但可能會發生變化,恕不另行通知。
]]>Biogen(納斯達克:BIIB)和Eisai, Co., Ltd.(日本東京)近日宣布,歐洲藥品管理局(EMA)已確認受理阿爾茨海默病試驗性治療藥物aducanumab的上市許可申請(MAA),并將按照標準時間表進行審評。阿爾茨海默病引起的輕度認知障礙和阿爾茨海默病患者的臨床數據表明,aducanumab治療可去除β淀粉樣蛋白,具有更好的臨床效果。如果獲得批準,aducanumab將成為第一個能夠延緩阿爾茨海默病臨床癥狀衰退的治療方法。
Biogen首席執行官Michel Vounatsos表示”阿爾茨海默病已經成為全球社會日益嚴重的負擔,我們相信aducanumab是可以改變這種毀滅性疾病進程的第一個突破”。同時,Michel Vounatsos也表示”我們致力于與全球監管機構合作,并期待歐洲藥品管理局對該申請進行審評。”
Eisai Co., Ltd.首席執行官Haruo Naito博士表示”目前尚無可通過解決基礎疾病病理機制來影響阿爾茨海默病進展的治療方法。Aducanumab具有有效延緩臨床癥狀衰退的潛力,這為患有這種毀滅性疾病的患者和家庭帶來了新的希望”。同時,Eisai Co., Ltd.首席執行官Haruo Naito博士也表示”在我們努力使該潛在治療藥物在全球范圍內可及的過程中,歐盟接受上市許可申請是一個重要的里程碑。”
美國食品藥品監督管理局也已經接受了aducanumab的上市許可申請,并且授予首選審評資格。根據《處方藥使用者付費法案》(PDUFA),FDA的審評目標日期為2021年3月7日。
關于Aducanumab
Aducanumab(BIIB037)是一種用于治療阿爾茨海默病的試驗性人單克隆抗體。基于阿爾茨海默病引起的輕度認知障礙和阿爾茨海默病患者的臨床數據,aducanumab可能影響基礎疾病的病理生理機制,減緩認知和功能下降,并改善患者的日常生活活動能力,包括個人理財、做家務(如清潔、購物和洗衣)以及獨立出門旅行。如果獲得批準,aducanumab將成為第一個能夠有意義地改變阿爾茨海默病患者病程的治療方法。
Biogen根據合作開發和許可協議從Neurimmune獲得了aducanumab的許可。自2017年10月以來,Biogen和Eisai Co., Ltd.在全球范圍內合作開發和商業化aducanumab。
EMERGE和ENGAGE均為III期、多中心、隨機、雙盲、安慰劑對照、平行研究,旨在評價aducanumab的有效性和安全性。這兩項研究的主要目的是通過臨床癡呆評定量表-總分(CDR-SB)評分的變化,評價每月一次給予aducanumab與安慰劑相比在減少認知和功能損害方面的有效性。次要目的是使用簡易精神狀態檢查表(MMSE)、阿爾茨海默病評估量表-認知子量表13項(ADAS-Cog 13)和阿爾茨海默病合作研究-日常生活活動量表-輕度認知障礙版本(ADC-ADL-MCI),評估每月一次給予aducanumab與安慰劑相比對臨床評分降低的影響。
關于阿爾茨海默病
阿爾茨海默病是一種進行性神經系統疾病,會損害患者的思維、記憶和獨立性,導致患者過早死亡。該疾病目前并沒有藥物能夠制止、延緩或預防,是一種日益嚴重的全球健康危機,會對該疾病患者及其家庭產生影響。根據世界衛生組織(WHO)的數據,全球有數千萬人患有阿爾茨海默病,并且在未來幾年中,這一數字還將繼續增長,因此目前對治療阿爾茨海默病的醫療資源需求極高,耗資需數十億美元。
根據國際阿爾茨海默病協會發布的《2019年阿爾茨海默病年鑒》,估計歐盟約有1000萬人患有癡呆(不包括輕度認知障礙),其中阿爾茨海默病約占癡呆病例的60%-70%。
阿爾茨海默病的特征表現為大腦變化,包括毒性淀粉樣β蛋白斑塊異常蓄積,約在患者出現疾病癥狀前20年就已經開始出現。阿爾茨海默病引起的輕度認知障礙是該疾病的早期階段之一,在該癥狀開始變得更加明顯時,就可以被發現并被診斷。目前的研究工作側重于盡早發現并治療患者,以獲得減緩或阻止阿爾茨海默病進展的最佳時機。
?
關于Biogen
在Biogen,我們的使命清晰明確:我們是神經科學領域的先鋒。Biogen為全球患有嚴重神經系統和神經退行性疾病以及相關治療鄰近疾病的患者探尋、研發和提供創新療法。Biogen是Charles Weissmann、Heinz Schaller、Kenneth Murray與諾貝爾獎獲得者Walter Gilbert和Phillip Sharp攜手在1978年成立的全球首批生物科技公司之一。現今,Biogen擁有領先的多發性硬化治療藥物組合,推出了首個獲批的脊髓性肌萎縮癥治療藥物,將先進生物制劑的生物類似藥商業化,并專注于推進多發性硬化和神經免疫學、阿爾茨海默病和癡呆、神經肌肉疾病、運動障礙、眼科學、免疫學、神經認知障礙、急性神經病學和疼痛方面的研究項目。
公司經常在網站(網址:www.biogen.com)上發布對投資者可能很重要的信息。請在Twitter、LinkedIn、Facebook、YouTube等社交媒體上關注我們。
?
關于Eisai Co., Ltd.
Eisai Co., Ltd.是一家總部位于日本的領先全球制藥公司。Eisai Co., Ltd.的企業理念基于關心人類健康(hhc)理念,即將患者及家屬的利益放在首位,為提升其福祉做出貢獻。公司憑借研發機構、生產基地和銷售附屬公司的全球網絡,致力于通過針對醫療需求未得到充分滿足的靶病灶提供創新產品,尤其側重于神經學和腫瘤學戰略領域,實現公司的關心人類健康理念。
Eisai利用從阿爾茨海默病治療藥物研發和上市中獲得的經驗,建立”Eisai癡呆平臺。”Eisai計劃通過該平臺構建”癡呆生態系統”,與醫療機構、診斷開發公司、研究組織和生物風險投資公司等合作伙伴以及私人保險機構、金融業、健身俱樂部、汽車制造商、零售商和護理機構等合作伙伴合作,為癡呆患者及其家庭帶來新的福祉。欲了解更多關于Eisai Co., Ltd.的信息,請訪問https://www.eisai.com。
?
Biogen安全港
本新聞稿中包含前瞻性聲明,包括根據1995年美國《私人證券訴訟改革法案》中的安全港條款就潛在的監管討論、提交、批準及時間、aducanumab的潛在臨床影響、aducanumab的潛在獲益、安全性和有效性、阿爾茨海默病的治療、Biogen與衛材合作研發的預期獲益和潛力、Biogen商業業務和管線項目(包括aducanumab)的潛力以及與藥物開發和商業化相關的風險和不確定性做出的聲明。這些前瞻性聲明可通過諸如”目標”、”預期”、”相信”、”可以”、”估計”、”期望”、”預測”、”意向”、”也許”、”計劃”、”可能”、”潛在”、”將”等詞語和其他類似意義的詞語來識別。藥物開發和商業化涉及高風險,只有少數研發項目最終會成功實現產品的商業化。早期臨床試驗的結果可能不能代表后期或更大規模臨床試驗的完整結果或各項結果,也不能確保藥物會獲得監管部門的批準。讀者不應過分依賴這些前瞻性聲明或提供的科學數據。
這些前瞻性聲明涉及可能導致實際結果與此類聲明中反映的結果存在實質性差異的風險和不確定性,包括但不限于向監管機構提交的實際時間和內容以及監管機構做出的關于aducanumab的決定,監管提交所花費的時間可能比預期時間更長或比預期更難以完成,監管機構可能需要其他信息或要求開展進一步研究或者可能拒絕批準或可能延遲批準Biogen的候選藥物(包括aducanumab),臨床試驗期間獲得的其他數據、分析或結果可能產生的非預期問題,不良安全性事件的發生,非預期成本或延遲的風險,其他非預期障礙的風險,aducanumab開發和潛在商業化成功的不確定性,與aducanumab潛在上市相關的風險(包括醫療保健提供者對患者進行治療的準備工作、獲得和維持充分報銷aducanumab費用的能力和其他非預期困難或障礙),Biogen的數據、知識產權和其他所有權未能得到保護和執行以及與知識產權索賠和異議相關的不確定性,產品責任索賠,第三方合作風險,以及持續存在的COVID-19疫情對Biogen業務、運營結果和財務狀況造成的直接和間接影響。上述前瞻性聲明列出了很多可能導致實際結果與Biogen在任何前瞻性聲明中預期的結果不同的因素,但并未覆蓋全部的可能因素。投資者應考慮這一警示性聲明,以及Biogen最近的年度或季度報告以及Biogen向美國證券交易委員會提交的其他報告中確定的風險因素。這些前瞻性聲明基于Biogen目前的信念和預期,僅在本新聞稿發布之日發表。Biogen無任何義務公開更新任何前瞻性聲明,無論該等更新是基于新信息、未來開發,或者任何其他原因。
]]>衛材將進行4次關于lecanemab的口頭報告。第一次報告將介紹在臨床前阿爾茨海默病(AD)患者中新啟動的III期臨床研究AHEAD 3-45的臨床研究設計和初始篩選結果。第二次報告將介紹在早期AD患者中進行的II期臨床研究(研究201)獲得的淀粉樣蛋白相關影像學異常-水腫(ARIA-E)表現的最新分析結果。第三次報告將介紹研究201正在進行的開放性擴展(OLE)研究前12個月治療期間觀察到的腦部Aβ總量變化和ARIA-E表現的初步分析結果。第四次報告將介紹在早期AD患者中進行的III期臨床研究Clarity AD當前入組的受試者的基線特征。
其他主題包括與臨床試驗相關的在小鼠模型中觀察到的lemborexant對AD中不規則睡眠-覺醒節律障礙(Irregular Sleep-Wake Rhythm Disorder,ISWRD)的有效性,以及新型抗微管結合域(MTBR)tau抗體E2814的I期、首次用于人體(FIH)、單次遞增劑量(SAD)研究的結果。
關于aducanumab,Biogen Inc.(總部:美國馬薩諸塞州坎布里奇)將就其IIIb期重新給藥研究EMBARK的設計進行口頭介紹。2020年8月,向美國食品藥品監督管理局(FDA)提交的使用aducanumab治療AD的生物制品許可申請(BLA)被接受,并獲得了優先審評資格認定。
Lecanemab和aducanumab由衛材和Biogen Inc.共同開發。
與Sysmex Corporation(總部:Hyogo,“Sysmex”)聯合研究的、簡化血液AD診斷方法的工作進展,將進行海報展示,介紹“通過全自動免疫分析(HISCLTM*)測量血漿Aβ比值,預測根據淀粉樣蛋白PET Centiloid標準化結果定義的淀粉樣蛋白陽性”。
衛材在AD和癡呆的藥物研發方面擁有35年的經驗積累,希望能夠通過多維度的整體方法實現癡呆的防治。衛材致力于加快新藥研發,以推動解決患者及其家屬未滿足的醫療需求,增加其獲益。
*HISCLTM是Sysmex Corporation的商標。
■??衛材口頭演示介紹的主題列表
| 處于研究階段的藥物,會議序號 | 主題/計劃日期和時間(東部標準時間) |
| BAN2401
OC 2 |
BAN2401治療臨床前阿爾茨海默病的AHEAD 3-45研究:研究設計和初步篩選結果 現場口頭演示介紹:11月4日(星期三)10:00 AM-10:15 AM 問答環節:11月4日(星期三)11:25 AM-11:40 AM |
| BAN2401
OC 10 |
“Clarity AD:一項評價BAN2401治療早期阿爾茨海默病的III期、安慰劑對照、雙盲、平行組、18個月研究”的基線特征
口頭演示介紹,可于11月4日(星期三)按需觀看1:00 AM |
| BAN2401
OC 14 |
BAN2401和早期阿爾茨海默病的ARIA-E:早期阿爾茨海默病II期研究的藥代動力學/藥效學至事件發生時間分析 現場口頭演示介紹:11月5日(星期四)9:45 AM-10:00 AM 問答環節:11月5日(星期四)11:15 AM-11:30 AM |
| BAN2401
LB 24 |
在早期阿爾茨海默病受試者中進行的IIb期研究BAN2401-G000-201的開放性擴展研究中,12個月治療期內BAN2401對腦淀粉樣蛋白和ARIA-E結果的初步影響分析 現場口頭演示介紹:11月7日(星期六)12:10 PM-12:25 PM 問答環節:11月7日(星期六)12:25 PM-12:50 PM |
| Lemborexant
LB 15 |
阿爾茨海默病中的不規則睡眠-覺醒節律障礙:使用SAMP8小鼠品系作為動物模型,評估食欲素(下丘腦分泌素)雙受體拮抗劑Lemborexant的有效性口頭演示介紹,可于11月6日(星期五)按需觀看1:00 AM |
| E2814
LB 23 |
一項在健康志愿者中開展的新型抗Tau治療性抗體E2814的I期、首次用于人體(FIH)、單次遞增劑量(SAD)研究 現場口頭演示介紹:11月7日(星期六)11:55 AM-12:10 PM 問答環節:11月7日(星期六)12:25 PM-12:50 PM |
■??衛材海報展示的主題列表
| 處于研究階段的藥物,報告序號 | 主題/計劃日期和時間(東部標準時間) |
| 一般性介紹
P 60 |
阿爾茨海默病患者及其看護者的臨床評估量表結果與社交媒體在線描述的一致性 從11月4日(星期三)開始,可按需查看 |
■? Biogen口頭演示介紹的主題列表
| 處于研究階段的藥物,會議序號 | 主題/計劃日期和時間(東部標準時間) |
| Aducanumab
OC 3 |
EMBARK:一項在符合條件的阿爾茨海默病受試者中評價Aducanumab的長期安全性和有效性的IIIb期、開放性、單臂、安全性研究 現場口頭演示介紹:11月4日(星期三)10:15 AM-10:30 AM 問答環節:11月4日(星期三)11:25 AM-11:40 AM |
■? Biogen海報展示的主題列表
| 處于研究階段的藥物,報告序號 | 主題/計劃日期和時間(東部標準時間) |
| 一般性介紹
P 70 |
使用美國國家阿爾茨海默病協調中心(National Alzheimer’s Coordinating Center)數據,估計淀粉樣蛋白陽性患者的阿爾茨海默病的癥狀進展率 從11月4日(星期三)開始,可按需查看 |
■? Sysmex-衛材海報展示的主題列表
| 處于研究階段的藥物,報告序號 | 主題/計劃日期和時間(東部標準時間) |
| 一般性介紹
LP 10 |
通過全自動免疫分析測量的血漿Aβ比值,預測根據淀粉樣蛋白PET Centiloid標準化結果定義的淀粉樣蛋白陽性 從11月4日(星期三)開始,可按需查看 |
媒體咨詢:
衛材株式會社
公共關系部
+81-(0)3-3817-5120
[編者注]
1.關于衛材和Biogen聯合開發AD治療藥物
衛材和Biogen在AD治療藥物的開發和商業化方面進行了廣泛的合作。衛材是聯合開發lecanemab(開發代碼:BAN2401)(一種抗Aβ原纖維抗體)的領導者,Biogen是聯合開發aducanumab(Biogen用于治療AD患者的試驗性抗Aβ抗體)的領導者,衛材和Biogen計劃在全球范圍內申請這兩種藥物的上市許可。如果獲得批準,衛材和Biogen還將在美國、歐盟和日本等主要市場共同推廣這兩種藥物。
2.關于衛材與Sysmex的合作
衛材和Sysmex于2016年2月簽訂了一項全面的非排他性合作協議,旨在尋找新的癡呆診斷方法。兩家公司利用彼此的技術和知識,共同尋找下一代診斷方法,以便實現早期診斷、選擇治療方案和定期監測癡呆的治療效果。
3.關于Lecanemab(開發代碼:BAN2401)
Lecanemab是一種治療AD的人源化單克隆抗體,是衛材和BioArctic AB(總部:瑞典)之間戰略研究合作的成果。Lecanemab可選擇性結合中和并消除可溶性、毒性Aβ聚集體(原纖維),這些聚集體被認為加速了AD的神經系統變性進程。因此,lecanemab可能對疾病病理機制產生影響,并減緩疾病進展。根據2007年12月與BioArctic簽訂的協議,衛材獲得了用于治療AD的lecanemab的全球研究、開發、生產和上市的權利。目前,lecanemab治療早期AD的全球III期臨床研究(Clarity AD)正在進行中。Lecanemab正在由衛材和Biogen Inc.聯合開發。美國國家衛生研究院、國家老齡化研究所為A45研究(撥款編號R01AG061848)和A3研究(撥款編號R01AG054029)提供資金。
4.關于Lemborexant
Lemborexant是衛材自主研發的一種小分子食欲素受體拮抗劑,通過競爭性結合食欲素受體的兩種亞型(食欲素受體1和2)抑制食欲素神經傳遞。Lemborexant對食欲素受體2的快速開/關受體動力學也可抑制非REM睡眠,可能影響lemborexant改善入睡和維持睡眠的潛力。2020年6月,lemborexant以產品名稱DAYVIGOTM在美國上市,用于治療以入睡困難和/或維持睡眠困難為特征的成人失眠患者;2020年7月,lemborexant以產品名稱DAYVIGO?在日本上市,用于治療失眠。衛材已在加拿大、澳大利亞和香港提交了DAYVIGO的新藥申請。此外,一項在輕中度阿爾茨海默病癡呆導致的ISWRD患者中進行的lemborexant II期臨床研究正在進行中。
5.關于Aducanumab(開發代碼:BIIB037)
Aducanumab是一種用于治療AD的試驗性人單克隆抗體。基于臨床數據,aducanumab可能影響基礎疾病的病理生理機制,減緩認知和功能下降,并改善患者的日常生活活動能力,包括個人理財、做家務(如清潔、購物和洗衣)以及獨立出門旅行。如果獲得批準,aducanumab將成為第一個能夠有意義地改變阿爾茨海默病患者病程的治療方法。
Biogen根據合作開發和許可協議從Neurimmune獲得了aducanumab的許可。自2017年10月以來,Biogen和衛材在全球范圍內合作開發和商業化aducanumab。
EMERGE和ENGAGE是III期、多中心、隨機、雙盲、安慰劑對照、平行組研究,旨在評價aducanumab的有效性和安全性。這兩項研究的主要目的是通過臨床癡呆評定量表-總分(CDR-SB)評分的變化,評價每月一次給予aducanumab與安慰劑相比在減少認知和功能損害方面的有效性。次要目的是使用簡易精神狀態檢查表(MMSE)、阿爾茨海默病評估量表-認知子量表13項(ADAS-Cog 13)和阿爾茨海默病合作研究-日常生活活動量表-輕度認知障礙版本(ADC-ADL-MCI),評估每月一次給予aducanumab與安慰劑相比對臨床評分降低的影響。
]]>預計在REMAP網絡內的多個國際試驗中心對安進的阿普斯特和衛材的依立托倫進行評價
(美國商業新聞社)-全球適應性研究聯盟(加利福尼亞州洛杉磯)、安進(加利福尼亞州千橡市)和衛材株式會社.(日本東京,簡稱”衛材”)聯合報道——全球適應性研究聯盟(GCAR)攜手安進和衛材,近日正式宣布REMAP-COVID免疫調節療法研究入組首例患者,這是REMAP-CAP(一項針對社區獲得性肺炎的隨機、嵌入式、多因素、自適應平臺試驗)的一項子研究,旨在檢驗COVID-19住院患者的多種治療干預措施,目前正在評價安進的阿普斯特和衛材的試驗性藥物依立托倫是否可以作為治療藥物。
REMAP-CAP的設計目標是在非大流行病及大流行病環境下尋找針對重癥肺炎的最佳治療方案。2020年2月,在COVID-19暴發初期時,REMAP-CAP迅速轉向大流行模式(REMAP-COVID子研究),按照其初衷,納入更多專門針對COVID-19的潛在治療方案,并將招募對象擴展至COVID-19患者。本試驗是一項多中心、隨機平臺研究,對不同通路或作用機制的治療方法進行檢驗。
該試驗正在UPMC(匹茲堡大學醫學中心)衛生系統的多家醫院以及美國的20多家醫院進行。隨后將在整個試驗網絡中增加其他全球研究中心。匹茲堡大學是美國區域協調中心。
“與生物制藥行業合作有利于高效檢驗已有的靶向藥物,對于了解COVID-19患者的治療模式至關重要。”Derek Angus,MD.,MPH,FRCP,美國REMAP主要研究者和UPMC衛生系統首席醫療保健創新官談到,”今天的公告標志著生物制藥行業、科學界和學術界攜手合作的一個重要里程碑,旨在聚眾家之力共同評估針對COVID-19住院患者的有前景的治療方法。”
安進的阿普斯特是一種口服藥物,可抑制PDE4(磷酸二酯酶4,一種在人體炎癥細胞中發現的酶)的活性。阿普斯特可通過抑制PDE4,調節炎性細胞因子和其他介質的產生,因此可能有助于抑制COVID-19患者中觀察到的與炎癥反應相關的癥狀、體征及肺部征象。阿普斯特口服制劑目前已在超過45個國家獲批用于治療炎性疾病,包括中重度斑塊狀銀屑病、銀屑病關節炎和與白塞病引起的口腔潰瘍。
“安進認為,基于其作用機制,阿普斯特可能有助于預防中重度COVID-19成人患者的呼吸窘迫。”安進研發執行副總裁David M. Reese談到,”我們很榮幸加入REMAP-COVID,這是一個利用平臺方法的重要創新舉措,有可能快速確定阿普斯特是否可以改善中重度COVID-19住院患者的健康結局。”
依立托倫是衛材通過天然產物有機合成技術自主研發的一種試驗性TLR4(Toll樣受體4)拮抗劑。它是類脂A的結構類似物,類脂A是細菌內毒素的活性藥效成分。在14項臨床研究(包括一項在重度敗血癥患者中進行的大型III期隨機試驗)中,已經觀察到該拮抗劑具有良好的安全性特征。預期可通過抑制TLR4的活化來控制COVID-19引起的炎癥和惡化;TLR4是引起細胞因子風暴的各種細胞因子基因表達信號傳遞的最上游。
“衛材很榮幸能夠參與這項開創性的REMAP-COVID,我們希望這項研究能夠深入評估依立托倫是否可以改善中重度COVID-19患者的健康結局并且得出有意義的結論。”衛材神經病學業務組首席醫療官Lynn Kramer, M.D., FAAN表示,”作為我們關心人類健康使命的一部分,公司一直致力于在全球范圍內為患者及其家人和醫療專業人員帶來改變。”
GCAR是REMAP-COVID的美國申辦方,正在努力促使全球多個制藥合作伙伴加入REMAP-COVID。
“GCAR很高興能夠利用我們在實施和監督創新試驗方面的專業知識,一起推進這項重要工作。”GCAR首席執行官Meredith Buxton博士表示,”我們致力于與制藥公司和REMAP網絡密切合作,通過擔任這項重要創新平臺試驗的美國申辦方,為COVID-19患者尋找新的有效治療方法。”
?
關于REMAP-CAP
REMAP-CAP由危重癥、臨床試驗、大流行病和傳染病暴發、病毒學、免疫學、急診醫學和貝葉斯統計方面的世界專家領導。REMAP-CAP已在19個國家的263個研究中心入組了2000多例患者。這項重要研究正在與適應性平臺試驗統計設計的領導者Berry Consultants合作進行,并得到了全球各國政府和非營利組織的支持。
欲了解更多關于REMAP-CAP和REMAP-COVID子研究的信息,請訪問www.remapcap.org并關注@remap cap
?
關于Otezla?(阿普斯特)
Otezla?(阿普斯特)是環磷酸腺苷(cAMP)特異性磷酸二酯酶4(PDE4)的口服小分子抑制劑。PDE4抑制可導致細胞內cAMP水平升高,因此可間接調節炎癥介質的生成。尚未明確Otezla在患者中發揮治療作用的具體機制。
Otezla可通過抑制PDE4,調節炎性細胞因子和其他介質的產生,因此可能有助于抑制COVID-19患者中觀察到的癥狀、體征及與肺部相關的炎癥反應。安進計劃與平臺試驗合作,研究Otezla治療COVID-19住院患者的效果。
?
Otezla?(阿普斯特)美國適應癥
Otezla?(阿普斯特)適用于治療適合光療或全身治療的中重度斑塊狀銀屑病成人患者。
Otezla適用于治療成人活動性銀屑病關節炎患者。
Otezla適用于治療白塞病引起的成人口腔潰瘍患者。
?
Otezla?(阿普斯特)美國重要安全性信息
禁忌癥
- Otezla?(阿普斯特)禁用于已知對阿普斯特或制劑中任何輔料存在超敏反應的患者
警告和注意事項
- 腹瀉、惡心和嘔吐:重度腹瀉、惡心和嘔吐病例與使用Otezla有關。大多數事件發生在治療的前幾周內。部分患者需要住院治療。65歲或以上的患者和正在服用的藥物可能導致血量缺少或低血壓的患者可能更容易發生嚴重腹瀉、惡心或嘔吐等并發癥。監測更容易發生腹瀉或嘔吐并發癥的患者;建議患者在發生此類情況時聯系其醫療服務提供者。如果患者出現重度腹瀉、惡心或嘔吐,考慮降低Otezla劑量或暫停給藥。
- 抑郁:謹慎權衡有抑郁和/或自殺想法/行為史的患者或在使用Otezla期間出現此類癥狀的患者使用Otezla的風險和獲益。應告知患者、護理者和家屬,需要警惕抑郁、自殺想法或其他情緒變化的出現或惡化,如果發生此類變化,應立即聯系其醫療服務提供者。
o??銀屑病:Otezla治療與抑郁增加相關。在臨床試驗期間,1.3%(12/920)的患者報告抑郁,而安慰劑組為0.4%(2/506)。Otezla組有0.1%(1/1308)的患者報告嚴重抑郁,而安慰劑組患者未報告(0/506)。Otezla組有0.1%(1/1308)的患者觀察到自殺行為,而安慰劑組為0.2%(1/506)。1例接受Otezla治療的患者企圖自殺;1例接受安慰劑治療的患者自殺。
o?銀屑病關節炎:Otezla治療與抑郁增加相關。在臨床試驗期間,1.0%(10/998)的患者報告抑郁或心境抑郁,而安慰劑組為0.8%(4/495)。在接受Otezla治療的患者中,0.2%(3/1441)的患者觀察到自殺想法和行為,而安慰劑組未觀察到自殺想法和行為。Otezla組有0.2%(3/1441)的患者報告嚴重抑郁,而安慰劑組患者未報告(0/495)。安慰劑組的2例患者自殺,而Otezla組無自殺。
o?白塞病:Otezla治療與抑郁增加相關。在III期臨床試驗期間,1%(1/104)的患者報告抑郁或心境抑郁,而安慰劑組為1%(1/103)。Otezla或安慰劑組的患者未報告自殺想法或行為。
- 體重減輕:定期監測體重;評估不明原因或具有臨床意義的體重減輕,并考慮停用Otezla
o?銀屑病:在臨床試驗期間,Otezla組12%(96/784)的患者和安慰劑組5%(19/382)的患者體重減輕5-10%。Otezla組2%(16/784)的患者體重減輕≥10%,安慰劑組中為1%(3/382)
o?銀屑病關節炎:在臨床試驗期間,Otezla組10%(49/497)的患者和安慰劑組3.3%(16/495)的患者報告體重減輕5-10%
o??白塞病:在臨床試驗期間,Otezla組4.9%(5/103)的患者和安慰劑組3.9%(4/102)的患者報告體重減輕>5%
- 藥物相互作用:當Otezla與強效CYP450酶誘導劑利福平聯合給藥時,阿普斯特暴露量降低;Otezla可能喪失療效。不建議Otezla與CYP450酶誘導劑(例如利福平、苯巴比妥、卡馬西平、苯妥英)合并使用
?
不良反應
- 銀屑病:≥5%的患者報告的不良反應為(Otezla%,安慰劑%):腹瀉(17,6)、惡心(17,7)、上呼吸道感染(9,6)、緊張型頭痛(8,4)和頭痛(6,4)
- 銀屑病關節炎:最長16周(初始5天劑量滴定后)期間Otezla組至少2%的患者報告、發生頻率比安慰劑組高至少1%的不良反應為(Otezla%,安慰劑%):腹瀉(7.7,1.6);惡心(8.9,3.1);頭痛(5.9,2.2);上呼吸道感染(3.9,1.8);嘔吐(3.2,0.4);鼻咽炎(2.6,1.6);上腹痛(2.0,0.2)
- 白塞病:最長12周期間Otezla組至少≥5%的患者報告、發生頻率比安慰劑組高至少1%的不良反應為(Otezla%,安慰劑%):腹瀉(41.3,20.4);惡心(19.2,10.7);頭痛(14.4,10.7);上呼吸道感染(11.5,4.9);上腹痛(8.7,1.9);嘔吐(8.7,1.9);背痛(7.7,5.8);病毒性上呼吸道感染(6.7,4.9);關節痛(5.8,2.9)
?
特殊人群用藥
- 妊娠:尚未在妊娠女性中對Otezla進行研究。應告知妊娠女性,使用本品可能會發生流產。有生育能力的女性應考慮避孕。一項妊娠暴露登記研究監測了妊娠期間暴露于Otezla的女性的妊娠結局。有關該登記研究的信息可通過以下方式獲得:電話:1-877-311-8972,網址:https://mothertobaby.org/ongoing- study/otezla/
- 哺乳期:尚無關于人乳中是否存在阿普斯特或其代謝物、阿普斯特對母乳喂養嬰兒的影響或藥物對乳汁生成的影響的數據。應綜合考慮母乳喂養對嬰兒發育和健康的獲益、母親的Otezla用藥臨床需求以及Otezla或母體基礎疾病對母乳喂養嬰兒的任何潛在不良影響
- 腎功能損害:重度腎
CBB由Cogstate開發,是一個經過科學驗證的數字工具,能夠進行認知功能自我檢測,通過四項測試來評估心理運動功能、注意力、學習記憶以及工作記憶。在美國、歐洲、澳大利亞、新西蘭和加拿大,CBB被做成了”CognigramTM“醫療設備,且已從這些地區的監管機構獲得市場授權,可為醫療人員提供信息性結果來支持臨床檢查,協助診斷MCI和癡呆。
衛材在中期商業計劃EWAY2025中設置的目標是成為一家”醫療社會創新公司”(通過研發藥物及提供解決方案來改變社會的公司)。衛材正在開創下一代醫學療法,專注于神經學和腫瘤學領域,并搭建各種疾病生態系統平臺,為早期診斷和早期治療提供包括數字解決方案在內的環境和解決方案。
Cogstate的目標是讓大腦健康評估和血壓評估一樣簡單、普遍、信息化。Cogstate的技術簡單易用,可提供70多種語言版本,獲得了包括600多份經同行評審的出版資料在內的廣泛科學驗證。COGTSTATE技術已在臨床試驗中廣泛應用,其中包括由衛材進行的多項試驗。
衛材和Cogstate之間的全球協議允許兩家公司復制已在日本推出的多項進展。衛材已結合CBB技術在日本開發了新型數字工具”NouKNOWTM“(發音為”NOH-NOH”,是一種用于大腦性能,或者說大腦健康狀態自我評估的非醫療設備),并已推向市場。目前,衛材正在調查在日本開發結合CBB技術的醫療設備的可能性。
近年來,各種研究表明,對生活方式進行重大調整,如經常鍛煉、規律睡眠、均衡飲食和社會交往,有可能減緩大腦機能衰退。不過,衛材的一項調查表明,采取恰當的預防措施或進行日常認知功能自檢的人很少,將這些習慣融入日常生活尚有不小差距(”鴻溝”)。
鑒于這些發現,在日本,衛材正在構建一個名為“Easiit”的癡呆患者平臺,意在消除這些鴻溝。該平臺的核心是大腦性能自檢工具”NouKNOW”和”Easiit App”(該應用旨在通過大腦和身體健康數據可視化來促進健康行動)。
可以預見的是,當前處于工作全盛期的一代人若使用”NouKNOW” 定期進行大腦功能自評,輔以”Easiit App”來調整生活方式并在日常生活中實施預防措施,將有機會創造更好的大腦和身體健康狀態。
通過這項協議,衛材和Cogstate將攜手開發數字工具,使認知功能自檢更為簡便,并為醫療保健專業人員開發診斷工具,在全球范圍內促進對大腦性能的更高認識,從而為實現全人類的福祉做出貢獻。
【編者按】
- 關于衛材株式會社
衛材株式會社的使命為”將患者及家屬的利益放在首位,為提升其福祉做出貢獻”,即關心人類健康(hhc)。衛材擁有約10,000名員工,遍布全球的研發中心、生產基地和營銷子公司。我們致力于通過研發創新產品來滿足醫療需求缺口,特別是腫瘤學和神經病學這兩個戰略領域,以此來實現我們的hhc理念。作為一家全球醫藥公司,我們的使命是通過與各關鍵利益相關者合作的形式來接觸到世界各地的患者,使我們的藥品能夠惠及發展中國家和新興國家。
有關衛材株式會社的更多信息,請訪問https://www.eisai.com。
- 關于Cogstate有限公司
Cogstate有限公司(ASX:CGS)是一家神經科學技術公司,總部位于澳大利亞維多利亞州的墨爾本市以及美國康涅狄格州的紐黑文市。公司專注于優化大腦健康評估,以此來推進新藥開發,讓較早期臨床洞察在醫療保健領域成為可能。自1999年以來,Cogstate技術已為越來越多的領域提供了快速、可靠和高靈敏度的計算化認知測試。該公司的臨床試驗解決方案中,包括了集電子數據采集、創新操作方法、先進分析和科學咨詢于一體的各種臨床結果評估質量保證服務。20多年來,Cogstate一直在努力滿足世界各地的生物制藥公司和學術機構的前沿研究需求,以及醫生和患者的臨床護理需求,并為此感到自豪。此協議不影響Cogstate繼續獨立地向臨床試驗市場提供技術和服務。
有關Cogstate的更多信息,請訪問網站www.cogstate.com。
]]>
媒體聯絡:
衛材株式會社
公共關系部
+81-(0)3-3817-5120
關于單藥治療部分性癲癇發作的申報資料是基于多項全球聯合治療臨床研究(研究304、305、306和335)中評估單藥治療的安全性和有效性的亞組分析,這些研究在美國、歐洲和中國的12歲及以上部分性癲癇發作(伴或不伴繼發性全面性癲癇發作)患者中進行。此外,在日本和韓國的12歲至74歲未經治療的部分性癲癇發作(伴或不伴繼發性全面性癲癇發作)患者中進行的一項III期臨床研究(FREEDOM/研究342)的結果作為補充安全性和有效性數據提交。
關于兒科部分性癲癇發作患者的申報資料是基于一項Fycompa III期臨床研究(研究311)的結果,該研究在全球范圍內使用Fycompa對部分性癲癇發作或原發性全面強直陣攣發作性癲癇控制不佳的兒科患者(年齡4至12歲以下)進行輔助治療。
據估計,在中國大約有900萬癲癇患者,盡管任何年齡均可能發病,但最常見的是18歲及以下兒童和青少年以及老年人。由于約30%的癲癇患者無法用目前的AEDs1來控制其癲癇發作,這是一種醫療需求顯著未得到滿足的疾病。
Fycompa是由衛材筑波研究實驗室研發的一種新型抗癲癇藥物,每日服用一次。該藥物是一種高選擇性、非競爭性的AMPA受體拮抗劑,通過靶向突觸后膜上AMPA受體處的谷氨酸鹽活性,減少與癲癇發作相關的神經元的過度興奮。Fycompa已在中國獲批作為12歲及以上癲癇患者的部分性癲癇發作(伴或不伴繼發性全面性癲癇發作)的輔助治療。
衛材認為包括癲癇在內的神經學是一個重點治療領域。隨著關于Fycompa的補充申請在中國獲得受理,衛材繼續追尋其使命,為全世界更多的癲癇患者提供有效的癲癇治療方法。衛材致力于滿足癲癇患者及其家人的各種需求,并為其提供更多福利。
?
媒體咨詢:
衛材株式會社
公共關系部
+81-(0)3-3817-5120
[編者注]
1.關于Fycompa(通用名:吡侖帕奈)
Fycompa是由衛材獨家研發的一種新型抗癲癇藥物。癲癇發作是由神經遞質谷氨酸介導的,該藥物是一種高選擇性、非競爭性的AMPA受體拮抗劑,通過靶向突觸后膜上AMPA受體處的谷氨酸鹽活性,減少與癲癇發作相關的神經元的過度興奮。Fycompa制劑現已上市銷售,每日一次,睡前口服。日本已批準片劑和細顆粒制劑。該藥的口服混懸劑和片劑已在美國和歐洲獲得批準。
目前,Fycompa已在70多個國家和地區,包括日本、美國、中國、以及歐洲和亞洲的其他國家,作為12歲及以上癲癇患者的部分性癲癇發作(伴或不伴繼發性全面性癲癇發作)的輔助治療。此外,Fycompa已被美國、日本、歐洲和亞洲等65多個國家批準作為12歲及以上癲癇患者的原發性全面強直陣攣發作性癲癇的輔助治療。在日本和美國,Fycompa獲批用于單藥治療和輔助治療4歲及以上癲癇患者的部分性癲癇發作(伴或不伴繼發性全面性癲癇發作)。迄今為止,Fycompa已被廣泛應用于治療全球超過300,000名患者(所有適應癥合計)。衛材正在全球范圍內進行一項III期臨床研究(研究338),意在將該藥用于治療與林-戈(Lennox-Gastaut)綜合征相關的癲癇發作。此外,衛材注射制劑的開發也在進行中。
2.關于在中國提交的Fycompa單藥治療部分性癲癇發作的追加申報資料所依據的III期臨床研究
中國Fycompa單藥治療的額外申報資料是基于在日本、中國和韓國進行的III期臨床研究(研究3352)的結果,以及在全球(包括美國、歐洲和中國)進行的三項III期臨床研究(研究3043、3054和3065)的結果。
研究335主要評價Fycompa在亞洲地區患者中的有效性和安全性。此外,研究304和305包括三個組(安慰劑、Fycompa 8mg和12mg),并將評價擴展的劑量范圍。研究306的關鍵目標是確定最小有效劑量,包括四個治療組(安慰劑組、Fycompa 2mg、4mg和8mg組)。
這些研究均為多中心、隨機、雙盲、安慰劑對照、平行組研究,受試者為診斷為部分性癲癇發作的12歲及以上患者,接受1至最多3種抗癲癇藥物。研究335的主要終點是癲癇發作頻率的百分比變化。歐洲獲批的研究304、305和306的主要終點是50%緩解率(與隨機化前相比,癲癇發作頻率降低50%或以上的患者百分比),而在美國獲批的主要終點是癲癇發作頻率的百分比變化。具體來說,結果表明:
1)??研究335
- 4、8和12mg Fycompa/天組的癲癇發作頻率變化百分比分別為-17.3%(p=0.223)、-29.0%(p=0.0003)、-38.0%(p<0.00001),而安慰劑組為-10.8%。
- 最常見的3種不良事件為頭暈、嗜睡和鼻咽炎。
2)??研究304
- 8mg和12mg Fycompa/天組的50%緩解率分別為37.6%(p=0.0760)和36.1%(p=0.0914),而安慰劑組為26.4%。
- 8mg和12mg Fycompa/天組的癲癇發作頻率變化百分比分別為-26.3%(p=0.0261)和-34.5%(p=0.0158),而安慰劑組為-21.0%。
- 最常見的6種不良事件為頭暈、嗜睡、易激惹、頭痛、跌倒和共濟失調。
3)??研究305
- 8mg和12mg Fycompa/天組的50%緩解率分別為33.3%(p=0.0018)和33.9%(p=0.0006),而安慰劑組為14.7%。
- 8mg和12mg Fycompa/天組的癲癇發作頻率變化百分比分別為-30.5%(p=0.0008)和-17.6%(p=0.0105),而安慰劑組為-9.7%。
- 最常見的4種不良事件為頭暈、疲乏、頭痛和嗜睡。
4)??研究306
- 2、4和8mg Fycompa/天組的50%緩解率分別為20.6%(p=0.4863)、28.5%(p=0.0132)和34.9%(p=0.0003),而安慰劑組為17.9%。
- 2、4和8mg Fycompa/天組的癲癇發作頻率變化百分比分別為-13.6%(p=0.4197)、-23.3%(p=0.0026)和-30.8%(p<0.0001),而安慰劑組為-10.7%。
- 最常見的3種不良事件為頭暈、頭痛和嗜睡。
?
3.關于FREEDOM(研究342)6
FREEDOM(研究342)是一項在日本和韓國開展的評價Fycompa單藥治療對12-74歲未經治療的部分性癲癇發作伴或不伴繼發性全身性癲癇發作患者的有效性和安全性的非對照、開放性、III期臨床研究。睡前口服最多4 mg Fycompa,每日一次(如果發生驚厥發作,可上調至8 mg)。本研究包含一個治療期和一個延長期,其中治療期包括6周的滴定期和26周的維持期(如果從4 mg劑量上調至8 mg,則滴定期為4周,維持期為26周)。在本研究中,89例患者接受Fycompa單藥治療,其中73例接受4 mg劑量的患者在治療期間未出現癲癇發作,該比例超過了有效性標準*,符合主要終點。此外,中期結果表明,接受4 mg和8 mg的患者的合并比例也超過了有效性標準。本研究中觀察到的最常見不良事件(發生率≥10%)為頭暈、嗜睡、鼻咽炎和頭痛,這與Fycompa迄今為止的安全性特征一致。
*本研究中73例可評價患者的有效性標準為52.1%或更高比例的患者達到無癲癇發作,該標準主要是根據其他AED單藥治療研究的結果設定。
4.關于研究3117
研究311是一項全球性(美國、歐洲、日本、韓國)開放性III期臨床研究,評估Fycompa口服混懸液作為輔助治療藥物給藥時用于180名4歲至12歲以下部分性癲癇發作或原發性全身強直陣攣性癲癇發作控制不佳的兒童癲癇患者的安全性、耐受性和暴露療效關系。這項研究包含一個治療期(包括長達11周的滴定期和長達12周的維持期)以及一個延長期。在這項研究中,每日睡前口服一次2~16mg Fycompa。主要終點是安全性和耐受性。療效與對12歲及以上患者觀察到的相似。在這項研究中觀察到的最常見的不良事件(發生率為10%或更高)是嗜睡、鼻咽炎、發熱、嘔吐、頭暈、流行性感冒、以及易怒,這與迄今為止Fycompa的安全特性一致。
5.關于癲癇
癲癇在中國影響了大約900萬人,在日本影響了大約100萬人,在美國影響了大約340萬人,在歐洲影響了大約600萬人,在全世界影響了大約6000萬人。由于約30%的癲癇患者無法用目前的AEDs1來控制其癲癇發作,這是一種醫療需求顯著未得到滿足的疾病。
癲癇大致按發作類型分類,部分性癲癇發作約占癲癇病例的60%,全身性癲癇發作約占40%。在部分性癲癇發作中,異常放電干擾發生在大腦的有限區域,并可能隨后擴散到整個大腦,成為全身性癲癇發作(稱為繼發性全身性癲癇發作)。在全身性癲癇發作中,異常放電干擾發生在整個大腦,隨后可能出現意識喪失或全身出現軀體癥狀。
1?“癲癇和癲癇發作:研究期望。什么是癲癇?”國立神經病學與中風研究所,2016年5月24日訪問,http://www.ninds.nih.gov/disorders/epilepsy/detail epilepsy.htm#230253109
2?Nishida T, et al.?吡侖帕奈輔助治療部分性癲癇發作:亞太地區隨機化III期研究。?Acta Neurol Scand.?2018年;第137期,第392-399頁。
3?French JA, et al. 吡侖帕奈輔助治療難治性部分性癲癇發作:隨機化III期研究304。Neurology.?2012年;第79期,第589-596頁。
4?French JA, et al.?評估吡侖帕奈輔助治療難治性部分性癲癇發作患者:全球隨機化III期研究305的結果。Epilepsia.?2013年;第54期,第117-125頁。
5?Krauss GL, et al.?隨機化III期研究306:吡侖帕奈輔助治療難治性部分性癲癇發作。Neurology.?2012年;第78期,第1408-1415頁。
6?Yamamoto, Takamichi et al.?吡侖帕奈單藥治療新診斷的局灶性癲癇發作或緩解期后的癲癇復發的有效性和安全性:開放性研究342(FREEDOM研究)。Epilepsia. 2020年;第5期,第274-284頁。.
7?Fogarasi, Andras et al.?開放性研究-旨在研究輔助治療藥物吡侖帕奈用于兒童(4歲至<12歲)局灶性癲癇發作或全身強直陣攣性癲癇發作的安全性和有效性。Epilepsia.?2020年;第61期,第125-137頁。
]]>東京大學(校長:Makoto Gonokami,“東京大學”)與衛材株式會社(總部:東京,CEO:內藤晴夫,“衛材”)近日宣布,已創建一個針對靶向蛋白質降解技術開發和新藥研發的合作項目,并設立社會合作項目“發現蛋白質降解藥物”。研究時間跨度為五年,從2020年10月1日到2025年9月30日。
??????? 社會合作課程是根據私營組織的資金而設立和運行的課程,這些私營組織致力于與東京大學針對共同關注公共問題展開研究合作。
??????? 在東京大學研究生院藥學院,將開設“發現蛋白質降解藥物”課程。國家健康科學研究所分子靶標和基因治療產品部前主任Mikihiko Naito博士被任命為該項目的項目教授,并將領導包括SNIPER在內的蛋白質降解技術的研究。這項研究將結合研究生院進行的世界上最先進的泛素蛋白酶體研究與衛材培養的藥物發現知識,以便開發針對藥物靶向蛋白質的新蛋白質降解技術,并促進基于該技術的藥物發現研究。此外,通過這項研究,該課程還將教育和培養該研究領域的下一代領導人。
??????? 靶向蛋白質降解是一系列技術,其中精確設計的化合物迫使靶蛋白質接近E3泛素連接酶,并應用泛素蛋白酶體系統來誘導靶蛋白質降解。該技術不僅為常規靶標(如特異性酶和受體),還為迄今為止難以發現藥物的疾病相關蛋白質提供一種藥物制備方法。通過這項技術開發和藥物發現,東京大學和衛材的目的是為先前治療選擇有限的患者提供新治療選擇。
[編輯注釋]
- 關于SNIPER
??????? SNIPER(特異性和非遺傳性IAP-依賴性蛋白質擦除器)是一種利用泛素蛋白酶體系統降解靶蛋白質的化合物。該化合物是一種“混合化合物”,并由一個與靶蛋白質結合的部分和一個通過合適的連接鍵與E3泛素連接酶(IAP)結合的部分組成。設計該化合物需要先進的藥物化學和最新的結構生物學。當SNIPER化合物使靶蛋白質和E3泛素連接酶(IAP)接近時(下圖中的步驟1),泛素作為蛋白質降解標簽從E2泛素結合酶轉移到靶蛋白質(2),用于蛋白酶體識別蛋白質及隨后的降解(3)。
??????? 常規小分子抑制劑與靶酶的活性部分結合,并通過抑制其活性來表達藥理活性。另一方面,由于SNIPER通過上述靶蛋白降解表現出藥理特性,不僅預計其表現出與小分子抑制劑不同的藥理活性;還預測其靶向不具酶活性的蛋白質。類似的技術包括PROTAC(蛋白水解靶向嵌合體)和Degronimid。
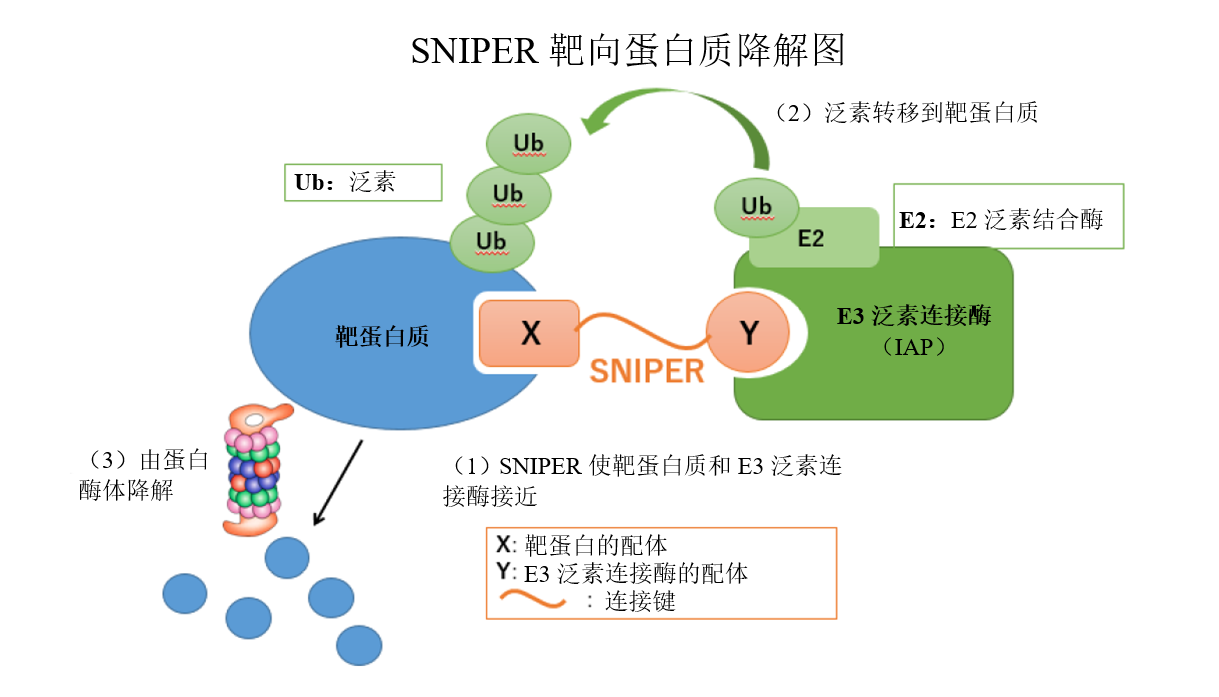
- 關于泛素蛋白酶體系統
??????? 泛素蛋白酶體系統是控制不需要的蛋白質降解的自然發生機制之一,并控制與生命保護相關的關鍵運動,包括細胞周期、轉錄調控和信號傳遞。當泛素作為蛋白質降解標簽通過試劑(如E3泛素連接酶)連接到不需要的蛋白質上時,其標記該蛋白質,用于蛋白酶體識別及隨后的降解。近年來,泛素蛋白酶體系統與人類主要疾病(包括癌癥和神經退行性變)之間的關系日益明顯。
]]>